
由芳基或烯基硼酸,羰基化合物和胺三组分反应制备苄基或烯丙基胺的反应,此反应也被称为硼酸Mannich反应或Petasis硼酸Mannich反应。1993, N.A. Petasis团队报道了利用烯基硼酸作为亲核试剂改进Mannich反应制备各种烯丙胺,此反应机理和Mannich反应类似【Tetrahedron Lett.1993, 34, 583-586】。该反应中使用了对水/空气稳定的烯基或芳基硼酸作为底物,可以用于合成诸如 α-氨基酸和 β-氨基醇这样的在合成化学中十分有用的产物。在使用手性α-羟基醛作为底物,可以得到高立体选择性的反式 β-氨基醇。该反应操作简便,只需把硼酸,胺,羰基化合物溶于溶剂中(通常是乙醇),室温搅拌即可。
反应特点:1、原始操作步骤:多聚甲醛和仲胺在甲苯或二氧六环中加热至90℃,搅拌10分钟,加入烯基硼酸,室温下搅拌数小时或加热至90℃反应30分钟;2、烯基硼酸反应后,双键的几何构型保留;3、此反应有很高的立体选择性;4、除了甲醛,其他醛酮都可进行此反应;5、当乙醛酸或α-酮酸作为底物时,反应可以得到α-氨基酸;6、烯基硼酸可以通过儿茶酚硼烷对端基炔加成后水解得到;7、烯基硼酸酯,芳基硼酸酯和有机氟硼酸钾也可以进行此反应;8、除了仲胺,芳胺,取代肼,取代羟胺和亚磺酰胺也可进行此反应;9、在Lewis酸活化下,2-羟基或2-烷氧基N-保护的吡咯烷和哌啶也可以进行作为底物进行此反应。10、此反应中加入手性小分子催化剂可以进行不对称合成反应。
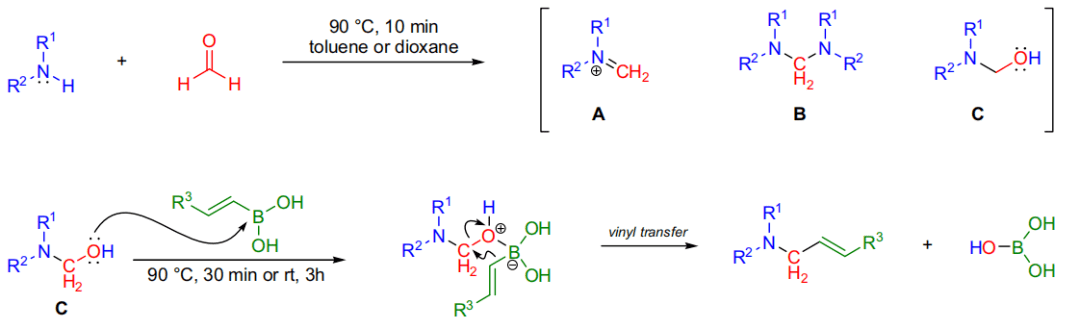
胺和醛缩合可能生成三种中间体:亚胺,二胺,α-羟基胺。可能的机理是α-羟基胺的羟基进攻亲电子的硼原子形成硼酸酯络合物,接着发生分子内的烯基迁移得到烯丙胺产物和硼酸副产物。
醛酮底物中无保护的羧酸与羟基可以明显加速反应。或许这也从一方面证明了该反应是经由烯胺离子与硼酸盐中间体进行的。